Le Secret Numérique et la superposition quantique
L’atome
Autour du noyau de l’atome gravitent
des électrons.
Bohr les décrivait en couches
concentriques.
La mécanique quantique décrit leur
probabilité de présence dans des « orbitales » définies par les nombres
quantiques n,l,m.
Chacune des orbitales m représente un
niveau possible d’énergie qui peut être occupé par un couple d’électrons liés
par leur spin
La forme des orbitales est elle-même
décrite par les niveaux s,p,d,f.
- Description quantique des niveaux d’énergie par les nombres quantiques n,l,m (résultat de la physique)
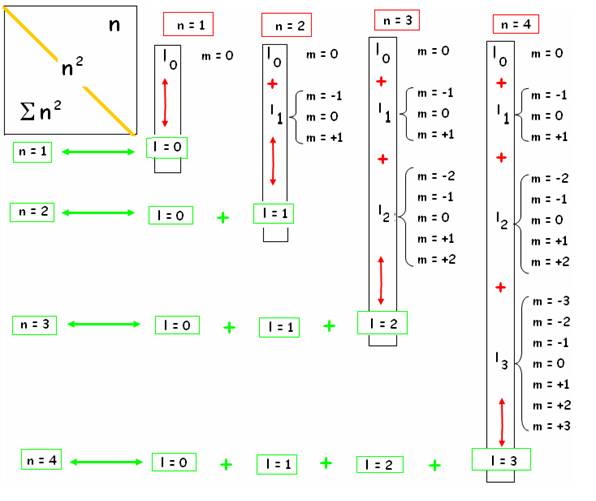
Une « couche » n est formée de n orbitales l
Une « sous-couche » l contient
(2l+1) orbitales m :
Constitution d’une couche l

Remarque :Chaque orbitale m
contient une paire d’électrons liés par leur spin.
Ainsi les niveaux m sont doubles, le nombre quantique de spin ms, multiplie par 2 les niveaux m.
Si comme les couches n, les couches l sont
concentriques (elles se superposent come des pelures d’oignon) :
Quelle est la structure d’un
niveau l : combien contient-il d’orbitales m ?
Je représente Les niveaux l se superposent :
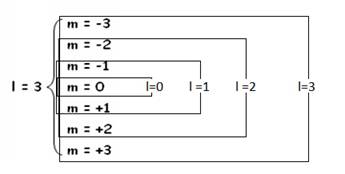
Superposition des niveaux l
On peut exprimer la superposition des couches l par la formule d’inclusion: à chaque niveau on ajoute 2 orbitales m.
(Je
représente l’orbitale m par le « contenant –spin » de 2
électrons).
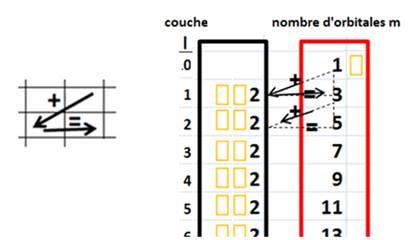
·
La
superposition quantique :
Les couches se superposent , tout niveau contient les niveaux qui lui sont inférieurs .
Ainsi le niveau de complétude l = 1 serait la superposition-somme inclusion des niveaux 0 et 1 ( en vert ci-dessous)
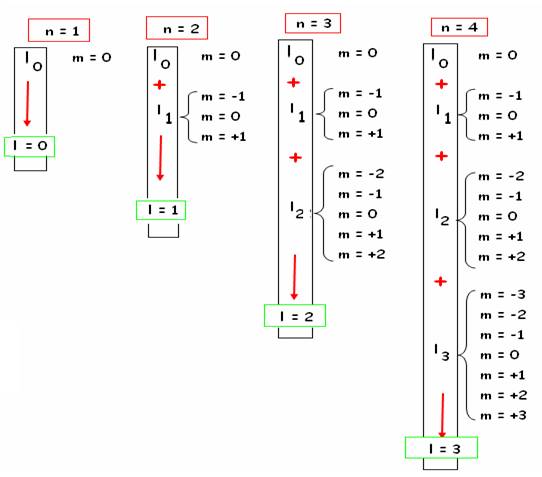
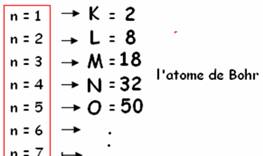
Par une nouvelle addition , on arriveà la
représentation du modèle de l’atome de
Bohr :
Dans une « couche n » il y a 2 n2
niveaux quantiques d’énergie ou orbitales ms.
- Je continue la superposition des couches n , pour construire « la complétude-orbitale », qui serait celle de l’atome.
(Ceci est une vision théorique arithmétique : dans la réalité physique les couches n s’interpénètrent et peuvent être décrites par les orbitales s,p ,d, f.)
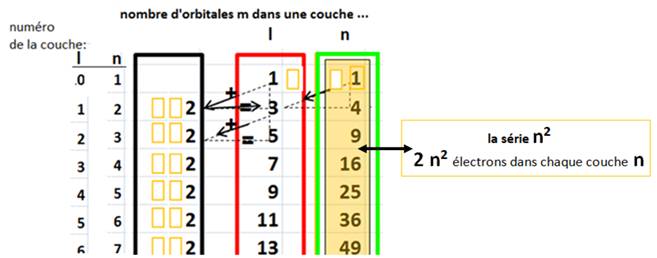
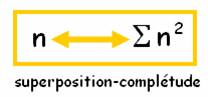
La superposition- complétude fait passer du nombre n , à la somme des carrés qui le constituent
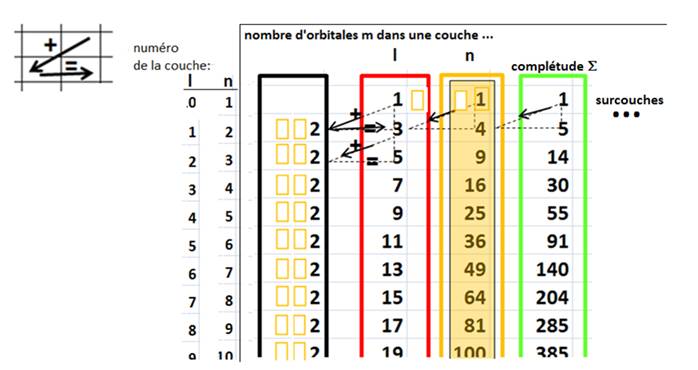
Ce résultat s’exprime dans une nouvelle colonne du tableau d’inclusion
Remarque :
Soit un électron dans une couche orbitale n .
Cet électron n’est pas localisable, on ne peut parler en théorie quantique que de sa probabilité de présence .
La superposition des sous-couches contient tous les états également possibles de l’électron : c’est la superposition quantique qui ne peut donner qu’une probabilité de présence en un lieu.
Sn2 la probabilité de présence dans l’ensemble des sous-couches.
Cette probabilité est forcément égale à
1. ∑n2 = 1.
Si on voit cette relation au niveau du nombre n = ∑n2 = 1 est une élégante façon (rapide) de montrer que tout nombre n est l’unité 1.
Nous avons montré que 1 = 2 = 3 = 4
Le principe d’inclusion, à partir de l’unité 2 (orbitale
m ou orbitale-spin), traduit de façon mathématique la superposition quantique dans l’atome..
Remarque : Le tableau d’inclusion ci-dessus peut être extrapolé, horizontalement et verticalement…
Le nombre de
couches d’un atome est actuellement connu jusqu’à n=7 et on ne connait pas le
sens physique de sur-couches éventuelles autour de l’atome .
Cette structure ne décrit pas l’interpénétration des couches décrite par les orbitales s,p,d,f.
Le principe
de superposition quantique , ou principe d’inclusion des orbitales s,p,d,f permettra de découvrir le mystère du tableau de Mendeleiev